Quotidiano on line
di informazione sanitaria
Venerdì 19 APRILE 2024
Scienza e Farmacidi informazione sanitaria
Venerdì 19 APRILE 2024
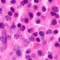
Sclerosi multipla. Buoni risultati per alemtuzumab nel primo anno di estensione dei trial
Più della metà dei pazienti trattati non ha presentato recidive durante il primo anno dello studio di estensione; al terzo anno, oltre due terzi dei pazienti in entrambi gli studi ha presentato un livello di disabilità migliore o stabile secondo la scala EDSS. I risultati presentati a San Diego.
24 MAR - Buoni risultati quelli ottenuti da alemtuzumab per il trattamento della sclerosi multipla (SM): nell’analisi del primo anno dello studio di estensione, i tassi di recidiva e l'accumulo sostenuto di disabilità sono rimasti bassi nei pazienti che avevano precedentemente assunto alemtuzumab in entrambi gli studi di fase III, CARE-MS I e CARE-MS II. In questi studi pivotal, alemtuzumab era stato somministrato in due cicli annuali, uno all'inizio dello studio e uno a 12 mesi di distanza. A darne annuncio è Genzyme, una società del Gruppo Sanofi.Gli studi di fase III su alemtuzumab sono studi pivotal randomizzati della durata di due anni,che hanno messo a confronto il trattamento con alemtuzumab rispetto a interferone beta-1a 44 mcg per via sottocutanea,in pazienti con SM recidivante-remittente non sottoposti in precedenza al trattamento (studio CARE-MS I) o che avevano avuto una recidiva durante la precedente terapia (studio CARE-MS II). Oltre il 90% dei pazienti che hanno partecipato agli studi pivotal di fase III è stato arruolato nello studio di estensione. Per ricevere l'ulteriore trattamento nello studio di estensione, i pazienti trattati inizialmente con alemtuzumab dovevano aver avuto almeno una recidiva oppure la comparsa o l'estensione di almeno due lesioni cerebrali o spinali.
Irisultati intermedi presentati oggi, riguardano il primo anno dello studio di estensioneper i pazienti che avevano precedentemente assunto alemtuzumabnegli studi a due anni. I dati di seguito riportati si riferiscono ai pazienti arruolati nello studio di estensione: più della metà dei pazienti trattati con alemtuzumab negli studi pivotal e arruolati nello studio di estensione non ha presentato recidive durante il primo anno dello studio di estensione; al terzo anno, oltre due terzi dei pazienti in entrambi gli studi ha presentato un livello di disabilità migliore o stabile secondo la scala EDSS; oltre l'80% dei pazienti trattati con alemtuzumabnegli studi pivotal non ha ricevuto un terzo ciclo di trattamento nel primo anno successivo all'ingresso nello studio di estensione.
“Questi dati sono importanti perché indicano che i benefici di alemtuzumab osservati negli studi di fase III perdurano, sebbene gran parte dei pazienti non abbia ricevuto ulteriori somministrazioni”,ha spiegato Edward Fox, Direttore della Multiple Sclerosis Clinic of Central Texas, che ha presentato i risultati dello studio al congresso annuale dell'Accademia Americana di Neurologia a San Diego, in California. I risultati di sicurezza del primo anno dello studio di estensione sono riferiti ai pazienti trattati con alemtuzumab negli studi pivotal di fase III.Non sono emersi nuovi rischi. La frequenza e la tipologia degli eventi avversi comuni e gravi nel primo anno dello studio di estensione, sono stati generalmente simili a quanto osservato negli studi pivotal di fase III.
“I risultati sottolineano quanto alemtuzumab sia straordinariamente promettente per i pazienti affetti dalla sclerosi multipla”, ha aggiunto David Meeker, Presidente e CEO di Genzyme. “E’ con grande orgoglio che presentiamo questi risultati a tre anni, che forniscono nuove importanti informazioni su alemtuzumab e sono coerenti con i risultati pubblicati del nostro studio di estensione di fase II.”
Le richieste di autorizzazione all’immissione in commercio di alemtuzumab per il trattamento della SM presentate da Genzyme, sono attualmente oggetto di valutazione da parte dell'Agenzia Europea dei Medicinali (EMA) e della Food and Drug Administration statunitense. E’ atteso per entrambe un riscontro in corso d’anno.
24 marzo 2013
© Riproduzione riservata
Altri articoli in Scienza e Farmaci
gli speciali
Quotidianosanità.it
Quotidiano online
d'informazione sanitaria.
QS Edizioni srl
P.I. 12298601001
Sede legale:
Via Giacomo Peroni, 400
00131 - Roma
Sede operativa:
Via della Stelletta, 23
00186 - Roma
Quotidiano online
d'informazione sanitaria.
QS Edizioni srl
P.I. 12298601001
Sede legale:
Via Giacomo Peroni, 400
00131 - Roma
Sede operativa:
Via della Stelletta, 23
00186 - Roma
Direttore responsabile
Luciano Fassari
Direttore editoriale
Francesco Maria Avitto
Luciano Fassari
Direttore editoriale
Francesco Maria Avitto
Tel. (+39) 06.89.27.28.41
info@qsedizioni.it
redazione@qsedizioni.it
Coordinamento Pubblicità
commerciale@qsedizioni.it
info@qsedizioni.it
redazione@qsedizioni.it
Coordinamento Pubblicità
commerciale@qsedizioni.it
- Joint Venture
- SICS srl
- Edizioni
Health Communication srl
Copyright 2013 © QS Edizioni srl. Tutti i diritti sono riservati
- P.I. 12298601001
- iscrizione al ROC n. 23387
- iscrizione Tribunale di Roma n. 115/3013 del 22/05/2013
Riproduzione riservata.
Policy privacy
- P.I. 12298601001
- iscrizione al ROC n. 23387
- iscrizione Tribunale di Roma n. 115/3013 del 22/05/2013
Riproduzione riservata.
Policy privacy