Quotidiano on line
di informazione sanitaria
Venerdì 19 APRILE 2024
Scienza e Farmacidi informazione sanitaria
Venerdì 19 APRILE 2024
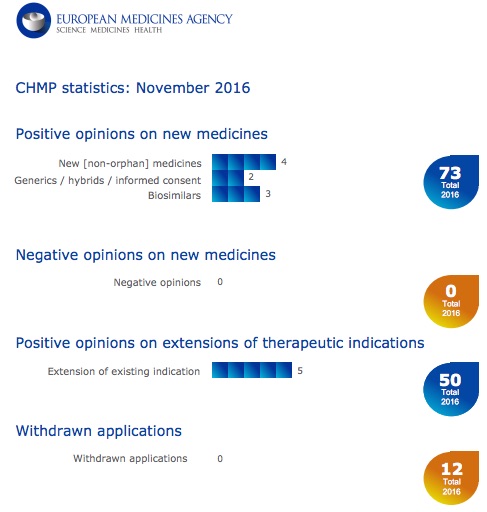
Ema. Emofilia, Diabete tipo 2 e non solo. Sì a nove nuovi farmaci di cui tre biosimilari
Questo l’esito della riunione di novembre del Comitato per i medicinali ad uso umano dell’Agenzia del farmaco europea (Ema). Ok a tre generici e 5 estensioni delle indicazioni terapeutiche.
11 NOV - Nove i farmaci raccomandati per l'approvazione, tra cui tre biosimilari. Questo l’esito della riunione di novembre del Comitato per i medicinali ad uso umano dell’Agenzia del farmaco europea (Ema).Semaforo verde del Chmp per: Afstyla (lonoctocog alfa) per la prevenzione e il trattamento di emorragie in pazienti con emofilia A; Vemlidy (tenofovir alafenamide) per il trattamento dell'epatite B cronica; Fiasp (insulina aspart) per il trattamento del diabete; Suliqua (insulina glargine / lixisenatide) per l'approvazione per il trattamento del diabete di tipo 2.
Parere positivo anche per tre farmaci biosimilari: Lusduna (insulina glargine) per il trattamento del diabete, e Movymia e Terrosa (entrambi teriparatide che contiene) per il trattamento dell'osteoporosi.
Sì anche a due farmaci generici: darunavir Mylan(darunavir) per il trattamento dell'infezione da virus dell'immunodeficienza umana (HIV-1) e Tadalafil Generics (tadalafil) per il trattamento dell'ipertensione arteriosa polmonare.
Sono state poi cinque le raccomandazioni per le estensioni delle indicazioni terapeutiche (Arzerra, Caprelsa, Humira, Nimenrix e Vimpat).
Il Comitato per i medicinali ad uso Umano (CHMP) ha completato la sua valutazione scientifica del rinnovo annuale dell’autorizzazione all'immissione in commercio condizionata per Translarna (ataluren) e ha raccomandato che l'autorizzazione all'immissione in commercio condizionata venga rinnovata. Come parte della valutazione del CHMP, il Comitato ha esaminato tutti i dati disponibili, inclusi i risultati di uno studio condotto dal titolare dell'autorizzazione all'immissione in commercio come requisito all'immissione in commercio condizionata dopo l'approvazione iniziale. Anche se i dati disponibili ad oggi continuano a indicare che Translarna rallenta la progressione della malattia e non ci sono rilevanti problemi di sicurezza, il comitato ha ritenuto che sono ancora necessari dati più completi per confermare pienamente che il rapporto rischio-beneficio del farmaco è positivo. Il CHMP ha quindi chiesto che il titolare dell'autorizzazione all'immissione in commercio per Translarna conduca un nuovo studio di 18 mesi, randomizzato, controllato con placebo in pazienti con distrofia muscolare di Duchenne, seguito da un periodo di 18 mesi in cui tutti i pazienti saranno passati a Translarna. I risultati dello studio dovrebbero essere disponibili nel primo trimestre del 2021.
Translarna è usato per il trattamento di pazienti dai cinque anni di età in poi affetti da distrofia muscolare di Duchenne, una condizione grave e rara per la quale non sono attualmente disponibili trattamenti autorizzati. Il farmaco deve essere usato in pazienti che sono in grado di camminare e la cui malattia è causata da uno specifico difetto genetico (chiamato 'mutazione nonsenso') nel gene per la proteina muscolare distrofina. L’approvazione condizionata permette all’EMA di raccomandare un farmaco per l'autorizzazione all'immissione in commercio, nell'interesse della salute pubblica, quando il beneficio della sua immediata disponibilità sia superiore al rischio inerente al fatto che sono ancora necessari dati aggiuntivi.
Questi farmaci sono soggetti a specifici obblighi di post-autorizzazione che mirano a generare dati completi sul medicinale. Le autorizzazioni all'immissione in commercio condizionate sono valide per un anno e possono essere rinnovate o convertite ad uno standard di autorizzazione all'immissione in commercio di cinque anni quando i dati aggiuntivi generati confermano che il rapporto rischio-beneficio del farmaco è positivo. Il rapporto di valutazione del rinnovo all'immissione in commercio condizionata per Translarna sarà pubblicato dopo che la Commissione Europea avrà emesso la propria decisione sul rinnovo.
11 novembre 2016
© Riproduzione riservata
Altri articoli in Scienza e Farmaci
gli speciali
Quotidianosanità.it
Quotidiano online
d'informazione sanitaria.
QS Edizioni srl
P.I. 12298601001
Sede legale:
Via Giacomo Peroni, 400
00131 - Roma
Sede operativa:
Via della Stelletta, 23
00186 - Roma
Quotidiano online
d'informazione sanitaria.
QS Edizioni srl
P.I. 12298601001
Sede legale:
Via Giacomo Peroni, 400
00131 - Roma
Sede operativa:
Via della Stelletta, 23
00186 - Roma
Direttore responsabile
Luciano Fassari
Direttore editoriale
Francesco Maria Avitto
Luciano Fassari
Direttore editoriale
Francesco Maria Avitto
Tel. (+39) 06.89.27.28.41
info@qsedizioni.it
redazione@qsedizioni.it
Coordinamento Pubblicità
commerciale@qsedizioni.it
info@qsedizioni.it
redazione@qsedizioni.it
Coordinamento Pubblicità
commerciale@qsedizioni.it
- Joint Venture
- SICS srl
- Edizioni
Health Communication srl
Copyright 2013 © QS Edizioni srl. Tutti i diritti sono riservati
- P.I. 12298601001
- iscrizione al ROC n. 23387
- iscrizione Tribunale di Roma n. 115/3013 del 22/05/2013
Riproduzione riservata.
Policy privacy
- P.I. 12298601001
- iscrizione al ROC n. 23387
- iscrizione Tribunale di Roma n. 115/3013 del 22/05/2013
Riproduzione riservata.
Policy privacy






