Quotidiano on line
di informazione sanitaria
Venerdì 19 APRILE 2024
Scienza e Farmacidi informazione sanitaria
Venerdì 19 APRILE 2024
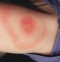
Emofilia A. Emicizumab designato breakthrough therapy dalla Fda
L’ente regolatorio statunitense ha designato nuovamente come breakthrough therapy la terapia messa a punto da Roche. La Fda concede questo status ai farmaci e alle terapie che rappresentano un’autentica novità, allo scopo di garantirne l’accesso ai pazienti il più rapidamente possibile
17 APR - La Food and Drug Administration degli Usa ha concesso a emicizumab, per la seconda volta, lo status di Breakthrough Therapy (Btd) per il regime di profilassi per la prevenzione o riduzione degli episodi di sanguinamento in tutti i pazienti con emofilia A. Emicizumab – messo a punto da Roche - è il primo anticorpo monoclonale bispecifico concepito per mimare l’azione del fattore VIII legando a ponte i fattori IXa e X, proteine necessarie per l’attivazione del processo di coagulazione del sangue.Questa terapia aveva già ricevuto la Btd per i pazienti con emofilia A con inibitori. Il nuovo riconoscimento Breakthrough Therapy è basata sui risultati ottenuti dallo studio di fase terza Haven 3, condotto su adulti di età superiore ai 12 anni con emofilia A senza inibitori. In ambito europeo, emicizumab ha già ottenuto la raccomandazione del Comitato per i Medicinali per Uso Umano (Chmp) per il trattamento di persone con emofilia A con inibitori e l’approvazione della Comunità Europea per tutte le fasce d’età.“I dati emersi dallo studio clinico Haven 1 con pazienti con inibitori del fattore VIII mostrano che quelli in terapia con emicizumab hanno avuto una riduzione dell’87% dei sanguinamenti trattati – dice Anna Maria Porrini, Country Medical Director di Roche In Italia – A oggi, gli studi clinici con emicizumab vedono arruolati circa 40 pazienti in otto diversi centri di riferimento. Infine, la somministrazione sottocutanea una volta a settimana in profilassi potrebbe contribuire a ridurre l’impatto del trattamento”.
“Le persone con emofilia, così come i loro familiari ampiamente coinvolti nella cura e assistenza dei loro cari, devono fare i conti con l’impatto di una patologia cronica che condiziona la quotidianità sin dalla nascita e nel corso dell’intera esistenza. Oggi siamo pronti a ridisegnare un futuro diverso. – aggiunge Maurizio de Cicco, Presidente e Amministratore Delegato di Roche Italia. -Noi di Roche puntiamo su una forte vocazione all’innovatività investendo con coraggio in programmi di ricerca e sviluppo per fare la differenza nella vita dei pazienti. La nostra storia, lunga 120 anni, ci ha sempre visto proiettati verso il futuro, orientati a trovare risposte concrete ai bisogni di salute non ancora soddisfatti. Questo vale oggi in modo significativo nel campo delle malattie rare e dell’emofilia”.
17 aprile 2018
© Riproduzione riservata
Altri articoli in Scienza e Farmaci
gli speciali
Quotidianosanità.it
Quotidiano online
d'informazione sanitaria.
QS Edizioni srl
P.I. 12298601001
Sede legale:
Via Giacomo Peroni, 400
00131 - Roma
Sede operativa:
Via della Stelletta, 23
00186 - Roma
Quotidiano online
d'informazione sanitaria.
QS Edizioni srl
P.I. 12298601001
Sede legale:
Via Giacomo Peroni, 400
00131 - Roma
Sede operativa:
Via della Stelletta, 23
00186 - Roma
Direttore responsabile
Luciano Fassari
Direttore editoriale
Francesco Maria Avitto
Luciano Fassari
Direttore editoriale
Francesco Maria Avitto
Tel. (+39) 06.89.27.28.41
info@qsedizioni.it
redazione@qsedizioni.it
Coordinamento Pubblicità
commerciale@qsedizioni.it
info@qsedizioni.it
redazione@qsedizioni.it
Coordinamento Pubblicità
commerciale@qsedizioni.it
- Joint Venture
- SICS srl
- Edizioni
Health Communication srl
Copyright 2013 © QS Edizioni srl. Tutti i diritti sono riservati
- P.I. 12298601001
- iscrizione al ROC n. 23387
- iscrizione Tribunale di Roma n. 115/3013 del 22/05/2013
Riproduzione riservata.
Policy privacy
- P.I. 12298601001
- iscrizione al ROC n. 23387
- iscrizione Tribunale di Roma n. 115/3013 del 22/05/2013
Riproduzione riservata.
Policy privacy