Quotidiano on line
di informazione sanitaria
Venerdì 19 APRILE 2024
Scienza e Farmacidi informazione sanitaria
Venerdì 19 APRILE 2024
Dai farmaci oncologici ai nuovi vaccini. Ecco tutte le novità che potrebbero arrivare nel 2020. Il Rapporto Aifa
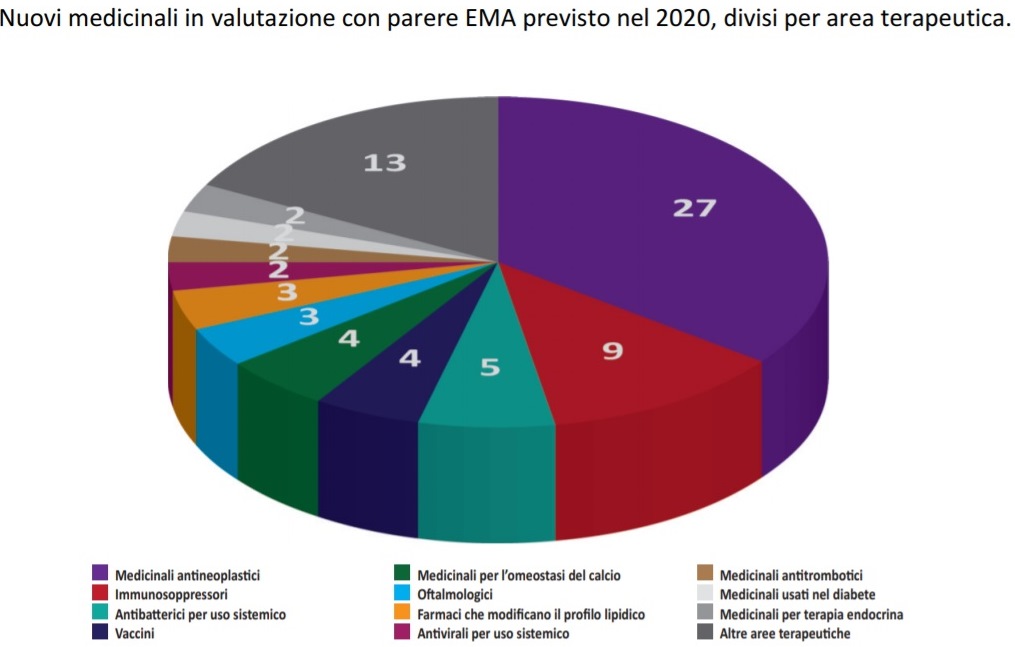
Pubblicato il report ‘Orizzonte farmaci’ dell’Agenzia del farmaco che fa il punto sui 76 medicinali per cui l’Ema ha in programma la valutazione nel 2020. “Nonostante la maggior parte dei medicinali in valutazione appartengano all’area terapeutica oncologica risulta rilevante anche la quota di medicinali in valutazione per altre aree terapeutiche, con particolare riferimento agli antibatterici ad uso sistemico e ai medicinali per le malattie autoimmuni”. IL RAPPORTO
14 FEB - Anti tumorali, antitrombotici, immunosoppressori, oftalmologici, anti diabete, antibatterici e antivirali per uso sistemico, vaccini e non solo. È ricco il menù dei nuovi farmaci che potrebbero essere approvati nel 2020 dall’Agenzia del farmaco europea (Ema).A fare il punto è il Rapporto Aifa “Orizzonte farmaci”. Il rapporto rientra tra le attività di Horizon Scanning dell’AIFA, che permettono di identificare e valutare precocemente nuovi medicinali e nuove indicazioni terapeutiche di medicinali già autorizzati che potranno ampliare le opzioni di trattamento a disposizione dei medici e dei pazienti colmando, pertanto, le esigenze di salute non ancora soddisfatte. In alcuni casi, si tratta di terapie che potrebbero avere un impatto significativo sul Servizio Sanitario Nazionale (SSN) e che, di conseguenza, impegneranno l’Agenzia nella definizione di strategie idonee a garantire ai cittadini l’accesso a cure innovative e personalizzate.
Nel corso del 2020 è infatti previsto un parere da parte dell’EMA per 76 medicinali: 44 medicinali contenenti nuove sostanze attive (di cui 22 medicinali orfani per il trattamento di patologie rare e 22 medicinali non orfani), 14 medicinali biosimilari e 18 medicinali equivalenti.
“Poiché è possibile – evidenzia Aifa - che non tutti i medicinali ricevano un parere positivo, il numero di quelli autorizzati alla fine del 2020 potrebbe risultare inferiore a 76”.
“Nonostante la maggior parte dei medicinali in valutazione appartengano all’area terapeutica oncologica – sottolinea il Report -, risulta rilevante anche la quota di medicinali in valutazione per altre aree terapeutiche, con particolare riferimento agli antibatterici ad uso sistemico e ai medicinali per le malattie autoimmuni. Infine, sono attualmente in valutazione due medicinali per terapie avanzate, rispettivamente per il trattamento dell’atrofia muscolare spinale (AMS) di Tipo 1 (Zolgensma) e per il trattamento della leucodistrofia metacromatica (OTL-200)”.
Ma nel Rapporto vengono anche ricordati i medicinali approvati nel 2019. L’anno passato sono stati autorizzati a livello europeo 51 nuovi medicinali: 31 medicinali contenenti nuove sostanze attive (di cui 7 medicinali orfani per il trattamento di patologie rare e 24 medicinali non orfani), 5 medicinali biosimilari e 15 medicinali equivalenti.
Tra i medicinali autorizzati, circa il 20% è rappresentato da medicinali oncologici destinati al trattamento di alcuni tipi di tumori, quali il tumore del polmone, della mammella e della pelle. Una percentuale rilevante riguarda, inoltre, i medicinali per l’apparato gastrointestinale e il metabolismo, antinfettivi ad uso sistemico e medicinali del sistema nervoso e per patologie del sangue. In particolare, tra questi ultimi, ha ricevuto il parere positivo dell’EMA una nuova terapia genica indicata per il trattamento di pazienti di età pari o superiore ai 12 anni affetti da beta talassemia trasfusione-dipendente, (Zynteglo). Sempre nel corso del 2019, hanno inoltre ricevuto un parere positivo dell’EMA 65 nuove indicazioni terapeutiche di medicinali già autorizzati.
14 febbraio 2020
© Riproduzione riservata
Altri articoli in Scienza e Farmaci
gli speciali
Quotidianosanità.it
Quotidiano online
d'informazione sanitaria.
QS Edizioni srl
P.I. 12298601001
Sede legale:
Via Giacomo Peroni, 400
00131 - Roma
Sede operativa:
Via della Stelletta, 23
00186 - Roma
Quotidiano online
d'informazione sanitaria.
QS Edizioni srl
P.I. 12298601001
Sede legale:
Via Giacomo Peroni, 400
00131 - Roma
Sede operativa:
Via della Stelletta, 23
00186 - Roma
Direttore responsabile
Luciano Fassari
Direttore editoriale
Francesco Maria Avitto
Luciano Fassari
Direttore editoriale
Francesco Maria Avitto
Tel. (+39) 06.89.27.28.41
info@qsedizioni.it
redazione@qsedizioni.it
Coordinamento Pubblicità
commerciale@qsedizioni.it
info@qsedizioni.it
redazione@qsedizioni.it
Coordinamento Pubblicità
commerciale@qsedizioni.it
- Joint Venture
- SICS srl
- Edizioni
Health Communication srl
Copyright 2013 © QS Edizioni srl. Tutti i diritti sono riservati
- P.I. 12298601001
- iscrizione al ROC n. 23387
- iscrizione Tribunale di Roma n. 115/3013 del 22/05/2013
Riproduzione riservata.
Policy privacy
- P.I. 12298601001
- iscrizione al ROC n. 23387
- iscrizione Tribunale di Roma n. 115/3013 del 22/05/2013
Riproduzione riservata.
Policy privacy