stampa | chiudi
Lunedì 09 DICEMBRE 2019
Epatite C. “A rischio eradicazione malattia. Parlamento intervenga per garantire permanenza farmaci nei fondi per gli innovativi”
L'appello di Ivan Gardini presidente di Epac onlus: “Abbiamo già curato 200.000 pazienti. Ma è urgente prevedere in legge di bilancio l’estensione dell’innovatività per i farmaci anti HCV la cui utilità sociosanitaria merita la permanenza nei fondi dedicati. Diversamente sbricioliamo un piano di eliminazione per l'epatite C ancor prima che nasca”
Abbiamo da poco raggiunto la soglia dei 200.000 pazienti con epatite C avviati a trattamento e curati dall’infezione nel 98-100% dei casi. Un successo europeo ed internazionale evidenziato anche in prestigiose riviste scientifiche. Ciò è stato reso possibile da un fattore chiave: l’istituzione di un fondo triennale di 500 milioni di euro dedicato esclusivamente ai farmaci non oncologici riconosciuti come innovativi, previsto dalla legge di bilancio 11 dicembre 2016, n. 232.
Purtroppo il fondo scade al 31.12.2019 e la stessa Legge pone alcuni limiti che inibiscono l’estensione dell’innovatività e, quindi, anche dei benefici a favore dei pazienti che derivano da un tale status.
Il comma 402 della citata legge recita: “Per gli effetti di quanto previsto ai commi 400 e 401, con determinazione del direttore generale dell'Agenzia italiana del farmaco (AIFA), previo parere della Commissione consultiva tecnico-scientifica, da adottare entro il 31 marzo 2017, sono stabiliti i criteri per la classificazione dei farmaci innovativi e a innovativita' condizionata e dei farmaci oncologici innovativi. Con la medesima determinazione sono definite le modalita' per la valutazione degli effetti dei predetti farmaci ai fini della permanenza del requisito di innovatività…”.
Non essendo specificato, si desume la possibile rivalutazione della permanenza del requisito innovatività per entrambe le classificazioni: ad innovatività piena (36 mesi) e condizionata (18 mesi).
Il comma 403, però, è perentorio: “Il requisito di innovativita' permane per un periodo massimo di 36 mesi”.
Sebbene in ritardo, con la Determina 12 Settembre 2017, AIFA definisce i criteri per la classificazione dei farmaci innovativi. La normativa prevede che “La permanenza del carattere di innovativita' attribuito ad un farmaco sara' riconsiderata nel caso emergano evidenze che ne giustifichino la rivalutazione”.
Ma, a mio parere, non è cosi’ chiaro se l’attività di rivalutazione si riferisce ai farmaci con piena innovatività o solo per quelli che hanno ottenuto l’innovatività condizionata. O per entrambi.
D’altra parte, e non a caso, si prevede un ulteriore decreto attuativo che dirima eventuali dubbi interpretativi: “Le modalità operative del disposto normativo sopra citato verranno esplicitate dal decreto attuativo del Ministero della Salute in corso di definizione”.
Ho cercato e ricercato questo decreto attuativo ma non ho trovato nulla, tantomeno nessuno da me interpellato mi ha indicato l’esistenza di tale decreto. Nell’incertezza normativa, si materializza la solita paralisi. Nessuno vuole prendere decisioni che possono incrementare la spessa farmaceutica, o “avvantaggiare” una o l’altra azienda farmaceutica senza analizzare a fondo le numerose ricadute positive che potrebbero andare perse per la salute dei cittadini.
Tutti o quasi si dimenticano che eliminare l’epatite C in centinaia di migliaia di pazienti implica risparmi nell’ordine di miliari di euro di costi diretti e indiretti, ma anche e soprattutto vite salvate e quantità industriali di anni di vita guadagnati.
Qualcosa che succede raramente in un secolo. Qualunque medico tira un sospiro di sollievo se il suo paziente elimina l’infezione da epatite C, perchè ormai la letteratura scientifica ci restituisce innumerevoli evidenze sui guadagni in salute: meno trapianti fegato, tumori del fegato, decessi epatocorrelati.
Tenendo d’occhio gli emendamenti alla legge di bilancio attualmente in discussione, abbiamo notato alcuni emendamenti che, in sostanza, prevedono di unificare i due fondi per i farmaci innovativi oncologici e non oncologici. Ma che, per come la vedo io, non risolve il problema.
Intanto ritengo che nell’era delle “medicina personalizzata” anche le regole amministrative dovrebbero essere ripensate in tale senso. Ad esempio, per i farmaci oncologici innovativi approvati di recente ed in previsione degli altri che a breve arriveranno in odore di innovatività, serve ancor di più un fondo dedicato, e magari ancor più capiente e con regole diverse finalizzate ad accelerare l’offerta terapeutica innovativa. Il cancro non aspetta. E a tale proposito sarebbe interessante conoscere il parere degli amici dell’AIOM.
Perché serve un intervento urgente per i farmaci anti epatite C? Le terapie innovative per la cura dell’epatite C attualmente inserite nel fondo per i farmaci innovativi non oncologici sono attualmente 3. La prima, non pangenotipica, perde il requisito di innovatività il 3 Febbraio 2020. Le altre 2, pangenotipiche, il 26 Aprile 2020.
Quand’anche il fondo innovativi fosse riconfermato, unico o separato qualsivoglia, questi farmaci usciranno dal fondo stesso e rimborsati tramite i fondi regionali di spesa corrente. Spesa notoriamente e costantemente sotto la lente di numerosi enti regolatori per motivi arcinoti.
La diretta conseguenza sarebbe una fatale battuta di arresto sulle attività poste in essere per la rapida eliminazione dell’epatite C nel nostro paese. E’ sufficiente analizzare gli andamenti prescrittivi delle Regioni che non accedono al fondo innovativi rispetto a quelle che accedono.
Non voglio neppure pensare che il Parlamento permetta tutto ciò. Essendo di parte, voglio elencare – tra i tanti – 4 ottimi motivi per rivalutare la permanenza dell’innovatività per i farmaci anti HCV:
• Per le eccezionali performance curative dei nuovi DAAs, che vantano tassi di cost-efficacy e cost-saving che non si riscontravano da decenni, e poichè il loro utilizzo produce salute e risparmi, la somministrazione di tali farmaci non deve subire alcun rallentamento ma, al contrario, vanno costruiti percorsi per incrementare il loro utilizzo anche con fondi dedicati, poiché, così facendo, negli anni a venire si libereranno le risorse risparmiate che confluiscono già ora in altri capitoli di spesa del SSN.
• Non risultano all’orizzonte o, meglio, in pipeline, farmaci innovativi nuovi o che dimostrano di poter migliorare le performance degli innovativi attualmente in commercio.
• Esiste una strategia mondiale di eliminazione del virus HCV (OMS global health strategy on viral hepatitis, 2016-2021) alla quale anche l’Italia ha aderito.
• I dati che AIFA divulga settimanalmente evidenziano una realtà impietosa: 1 paziente su 3 che viene avviato a trattamento ha una cirrosi o malattia molto avanzata e, quindi, i DAAs anti HCV sono da considerarsi tuttora farmaci salvavita;
Perché salvavita? Perché i dati degli avviamenti terapeutici settimanali divulgati da AIFA parlano chiaro: il 30% dei pazienti che inizia una cura con i farmaci innovativi ha una cirrosi (20%) o una malattia avanzata (10%)1. Tutti pazienti che rischiano il tumore del fegato. E solo nel 2019 sono stati avviati al trattamento oltre 10.000 pazienti con malattia avanzata e avanzatissima. Come mai questi pazienti non sono stati curati negli anni precedenti?
Per migliaia di pazienti alcuni mesi di ritardo nella eliminazione dell’infezione possono fare la differenza tra la comparsa di cellule tumorali oppure no. Il tutto ben documentato in letteratura.
Fig. 1. Epatite C: avviamenti terapeutici settimanali per gravità di malattia epatica. Fonte, AIFA. Riproduzione grafica EpaC onlus
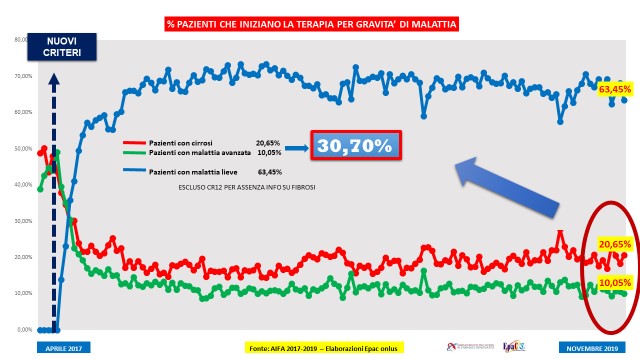
Fig. 2. Epatite C: avviamenti terapeutici complessivi 2019 per gravità di malattia epatica. Fonte, AIFA. Riproduzione grafica EpaC onlus
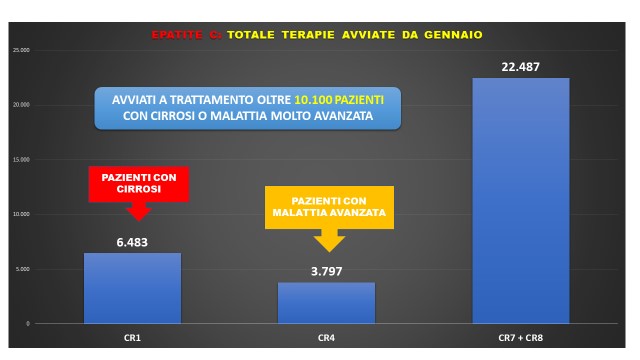
Siamo anche in attesa del rapporto conclusivo dell'indagine conoscitiva in materia di politiche di prevenzione ed eliminazione dell'epatite C, promossa dall’On. Michela Rostan, Vicepresidente della XII Commissione (Affari sociali), che ringrazio, unitamente a tutta la Commissione, per aver voluto approfondire un tema di salute collettiva così delicato
Concludo, auspicando un intervento di modifica al comma 403 della legge di bilancio 11 dicembre 2016, n. 232, che consentirebbe ad AIFA di rimodulare la Determina 12 Settembre 2017, affinchè la CTS possa rapidamente procedere alla rivalutazione del requisito di innovatività dei farmaci di grande impatto sociale e sanitario.
Ivan Gardini
Presidente Associazione EpaC onlus