stampa | chiudi
Lunedì 29 OTTOBRE 2018
Farmaci innovativi. I “Fondi speciali” hanno funzionato? Le strategie nazionali e regionali
Ciò che lascia maggiormente perplessi, al netto di alcune carenze di informazione, è la variabilità regionale dei consumi: infatti, essa è estremamente elevata, senza giustificazioni epidemiologiche sufficienti a spiegarla. Questo implica che le Regioni debbano potenziare il processo programmatorio e di monitoraggio, in modo da contemperare da una parte il diritto all’accesso e dall’altro un uso appropriato che eviti sprechi, garantendo la sostenibilità
Per il finanziamento dei farmaci innovatici, oncologici e non, è stata prevista, nell’ambito della governance farmaceutica italiana, una regolamentazione specifica, basata sulla istituzione di risorse/fondi vincolati. La regolamentazione ha origine con la L. n. 190/2014 (Legge di Bilancio 2015), con la quale è stato istituito il Fondo per il concorso al rimborso alle Regioni per l’acquisto dei medicinali innovativi.
Il fondo in questione, essenzialmente, è nato come risposta all’avvento sul mercato di nuovi farmaci ad alto costo, soprattutto quelli per l’HCV, essendosi generata una condizione, in qualche modo nuova per il SSN italiano, per cui una nuova opportunità terapeutica, seppure considerata in modo largamente condiviso innovativa, e con un profilo di costo-efficacia “accettabile”, creava comunque problemi di sostenibilità al sistema per effetto del suo complessivo impatto finanziario. Con la presumibile volontà di stemperare la problematica, è nata l’istituzione del Fondo per l’innovazione, che ha incrementato le risorse per il settore di € 500.000, sebbene solo il 20%, per il 2015, provenienti da fondi statali e quindi aggiuntivi, e per il resto ri-orientando risorse già previste per gli obiettivi di Piano.
L’incremento effettivo delle risorse è, quindi, limitato, ma l’indicazione a vincolare le risorse su un segmento specifico, identificato come quello dell’innovazione farmaceutica, ha rappresentato una novità rilevante.
La questione del Fondo è altrettanto rilevante in una ottica di governance complessiva del settore farmaceutico: pur essendoci larga condivisione sul fatto che sia necessario riformare l’attuale, su quali debbano essere le modifiche, e l’ispirazione della nuova governance, non sembra esserci ancora chiarezza; di certo, eventuali modifiche dei meccanismi di calcolo del pay-back o di suddivisione dello stesso fra le Aziende, sembrano non “dirimenti”: l’attuale governance, al di là dei contenziosi generatisi, sostanzialmente è andata in crisi perché il pay-back ha raggiunto livelli che non sono più gestibili da parte delle Aziende farmaceutiche. Da questo punto di vista, la gestione delle risorse aggiuntive al Fondo farmaceutico, rivestono una importanza cruciale: in particolare la decisione di non adire ad un ampliamento del tetto della farmaceutica, preferendo la strada della istituzione di un fondo “aggiuntivo”.
Su questo punto sembrano poter essere stati decisivi due elementi: il primo, legato al rischio di vedere l’aumento delle risorse disperdersi su altre tipologie di consumo farmaceutico; il secondo, legato alla volontà di non ampliare il fabbisogno sanitario in modo strutturale: l’istituzione di un Fondo, con previsione di finanziamento a termine (triennio 2017-2019), lascerebbe intendere che si tratti di una soluzione temporanea; scelta giustificata da ragioni di finanza pubblica e dall’obiettivo di evitare un aumento della quota di spesa sanitaria relativa alla farmaceutica.
Nel 2016, la L. n. 232/2016, ha ripreso e aggiornato la materia; in primo luogo, il finanziamento per il Fondo esplicitamente entra a far parte del Fabbisogno Sanitario Nazionale Standard (FSNS); in secondo luogo, viene istituito un ulteriore Fondo (quasi) gemello, per i farmaci Innovativi oncologici, anch’esso finanziato per € 500.000 a partire dall’anno 2017.
Si conferma, quindi, che i Fondi, rappresentano un “di cui” del finanziamento generale, la cui specificità è nella loro natura vincolata.
Da notarsi che nella quota vincolata, pari in totale a € 1,0 mld., è, peraltro, contenuta (nel 2017) anche una quota, pari al 10,0%, destinata all’acquisto di vaccini previsto nel Piano Nazionale della Prevenzione, ed una, pari al 7,5% per i processi di assunzione e stabilizzazione del personale del SSN.
Per inciso, questa inclusione dei Fondi nel Fabbisogno implica, altresì, che le Regioni a Statuto speciale autofinanzino (in tutto o in parte) la propria quota, come previsto dalle rispettive autonomie
Si conferma, inoltre, che una quota del Fondo Innovativi non oncologici (FI) sia a valere sulle risorse per gli obiettivi di Piano; da notarsi che, di contro, il Fondo Innovativi Oncologici (FIO) è tutto a valere sul Fabbisogno Sanitario Nazionale Standard.
Infine, la norma chiarisce che:
• è l’AIFA che deve determinare le condizioni di accesso ai Fondi definendo i criteri di innovatività (che sono stati, peraltro, definiti successivamente)
• l’innovatività è classificata in due “categorie”: “piena” e condizionata, ove quest’ultima non è esplicitamente citata come opzione per i farmaci oncologici.
• con l’innovatività condizionata, in sostanza, la differenza sta nel non avere accesso ai benefici economici
• l’innovatività è temporanea (massimo 36 mesi, che si riducono a 18 in caso di innovatività condizionata) e rivalutabile (attraverso i registri di monitoraggio)
• sul punto precedente va rimarcato che, ai sensi della det. AIFA 1535, di fatto si passa da una valutazione per molecola ad una per indicazione (sebbene la regola sia stata applicata non sempre in modo rigido) e che i second comers beneficiano dell’innovatività per il tempo residuo rispetto ai 36 mesi concessi al farmaco che per primo ha avuto la innovatività
• l’eventuale sforamento dei Fondi è da imputarsi al tetto (riformato) della farmaceutica per acquisti diretti
• il riparto regionale dei Fondi è effettuato sulla base della spesa sostenuta per i residenti (confermando così quanto previsto nella L. 190/2014).
Analizzando la normativa richiamata, nell’ottica di esplicitarne gli incentivi messi in atto, può rinvenirsi, con ragionevole certezza, che il suo obiettivo primario sia rappresentato dalla volontà, di favorire l’accesso ai farmaci innovativi, intesi come quelli ad elevato valore terapeutico aggiunto (Det. AIFA 1535/2017), attraverso l’istituzione dei Fondi.
Appare, altresì, incontrovertibile che la disponibilità regionale di risorse aggiuntive (almeno in parte), e anche vincolate, rappresenta da questo punto di vista un incentivo potenzialmente efficace.
Non di meno, le risorse “davvero” aggiuntive sono relativamente scarse, se non nulle: come anticipato, la vera “novità” dei Fondi è quella di riservare ai farmaci innovativi una quota del FSN. Da questo vincolo, deriva, la premialità per le aziende che portano sul mercato farmaci innovativi.
Anche in questo caso la posizione dell’AIFA è esplicita, richiamando «l’incentivo allo sviluppo di farmaci che offrano sostanziali benefici terapeutici» (Det. AIFA 1535/2017).
La premialità ha tre elementi cardine: il primo, “intangibile”, rappresentato dal riconoscimento dell’innovatività, la cui valutazione appare però complessa.
Il secondo, è rappresentato dall’inserimento automatico del farmaco nei prontuari regionali con un conseguente potenziale accorciamento dei tempi di accesso al mercato. Sebbene il vantaggio sia sulla carta indiscutibile, la sua effettività è, di contro, discutibile: come sarà evidente nel seguito, i consumi e gli up-take regionali rimangono profondamente difformi, dimostrando che, non è di fatto sufficiente la garanzia di un inserimento “formale” nei prontuari per garantire l’accesso al mercato.
Il terzo elemento è quello economico, che ha una doppia dimensione: la prima è quella dell’esclusione dal pay-back fino a concorrenza dei Fondi stanziati: questo è certamente un tangibile beneficio economico, sebbene in parte mitigato dalla previsione (L. n. 190/2014) di un limite di fatturato (posto a € 300 mil.) sopra il quale l’esenzione si riduce all’80% del fatturato stesso).
La seconda dimensione è quella legata al prezzo negoziato: da questo punto di vista è, però, dubbio che venga davvero riconosciuto un vantaggio ai farmaci innovativi (ad es. sugli oncologici si vd. Polistena B., Giannarelli D., Spandonaro F., 2016, Riflessioni sulla determinazione del valore dei farmaci oncologici: un’analisi sui farmaci di prima linea per i tumori metastatici, GRHTA, 3(1):9-15 e Polistena B., Giannarelli D., Spandonaro F., (2017), Ulteriori riflessioni sulla determinazione del valore dei farmaci oncologici alla luce dell’approvazione dei nuovi farmaci immuno-terapici, GIHTAD 10:1)
A fronte della premialità sopra analizzata, rimangono però a carico delle aziende alcuni elementi di rischio.
Il più importante è certamente quello legato ad un possibile effetto “boomerang”, qualora la richiesta (per la procedura di valutazione dell’innovatività non è peraltro necessaria la richiesta dell’Azienda produttrice) di riconoscimento dell’innovatività per indicazione venga rifiutata, essendo la sua valutazione di difficile quantificazione.
Certamente il rischio è elevato se, sinora, l’AIFA ha riconosciuto l’innovazione a ben poche molecole: in tutto 26 molecole.
Inoltre, la complessità della materia, e conseguentemente del modello adottato da AIFA, rendono a priori estremamente difficile prevedere l’esito della valutazione, generando un rischio, e quindi un potenziale vulnus nell’incentivo verso lo sviluppo di farmaci innovativi.
Agli aspetti controversi sopra richiamati, si aggiunge che è dubbia l’efficienza di un incentivo che viene “erogato” ex post; il beneficio è, infatti, offerto al momento dell’accesso al mercato; ma, essendo l’obiettivo dichiarato quello di incentivare lo sviluppo di farmaci portatori di sostanziali benefici terapeutici, sarebbe certamente preferibile una incentivazione ex ante, quindi della ricerca, nei settori ritenuti meritori, ovvero dove si ritenga siano maggiori gli unmet needs.
Sul lato delle politiche industriali non sembra, quindi, che la governance dell’innovazione sia scevra da problematiche; a ben vedere, non lo è neppure sul lato delle politiche assistenziali, e quindi da un punto di vista della governance del SSN.
Su questo secondo aspetto, il punto essenziale è quello che riguarda l’accesso regionale ai Fondi, basato sulla proporzionalità rispetto alla spesa sostenuta; questa previsione per un verso risponde ad esigenze epidemiologiche (ad esempio maggiore prevalenza dell’HCV nel meridione, e viceversa maggiore prevalenza di patologie oncologiche nelle Regioni settentrionali più anziane), per un altro si espone al rischio di critiche in quanto potrebbe generare incentivi perversi sul lato dell’appropriatezza nell’utilizzo dei farmaci e/o inefficienze gestionali: in altri termini, i criteri di presa in carico dei pazienti con HCV, o eventualmente la scelta del mix prescrittivo in campo oncologico, potrebbero seguire strategie regionali diversificate; il “ripiano a piè di lista” della spesa incentiva l’accesso, ma non disincentiva le differenze nelle strategie prescrittive regionali.
La controdeduzione possibile è che trattasi di farmaci innovativi, per lo più anche soggetti a Managed Entry Agreements (MEA), e quindi con consumi fortemente monitorati, elemento che implica rischi di inappropriatezza d’uso decisamente ridotti.
Sebbene, in via di principio, una equa ripartizione dei Fondi richiederebbe la determinazione di un fabbisogno regionale standard di farmaci innovativi, la sua stima risulta essere complessa, e probabilmente non si è ancora adeguatamente attrezzati, richiedendo valutazioni dell’epidemiologia regionale delle patologie, oltre che dei prezzi efficienti di acquisto.
Sempre in via di principio, un riparto sui consumi incentiverebbe la programmazione da parte delle Regioni al fine di tenere sotto controllo tanto le procedure di approvvigionamento, quanto quelle di pay-back, ove ad esempio previste dai MEA.
Non può essere neppure sottovalutato il fatto che il riparto sulla spesa è operativamente di complessa gestione, per effetto dell’azione dei meccanismi di remunerazione price-volume e, in generale, di scontistiche variamente definite, molte delle quali si palesano per il loro valore solo ex post, spesso a distanza di mesi.
In parte, a questa istanza risponde il Decreto 16.2.2018 del Ministero della Salute, che recepisce un accordo della Conferenza Stato-Regioni, con cui si sancisce che la spesa di cui alla L. 232/2016 è da intendersi quale prodotto tra il numero di confezioni erogate ai residenti ed il prezzo netto (degli eventuali accordi negoziali) per il SSN: dati elaborati dall’AIFA sulla base anche dei registri di monitoraggio.
Questo implica che, sul lato del prezzo, si sia in effetti addivenuti alla decisione di utilizzare un riferimento “standard”; la stessa cosa non avviene sul lato dei consumi: quindi lasciando irrisolto il problema dell’appropriatezza degli stessi.
In pratica, per (solo) il 2017, e per il FIO (che al monitoraggio provvisorio 2017 di AIFA risultava sottoutilizzato), il riparto è previsto avvenga indipendentemente dai consumi, ovvero sulla base delle quote di riparto del fabbisogno regionale standard: si configura quindi un finanziamento aggiuntivo “indistinto”, da cui rimangono escluse (in toto o in parte) le Regioni a Statuto speciale.
In definitiva, gli obiettivi perseguiti con l’istituzione dei Fondi per i farmaci innovativi (oncologici e non) appaiono chiaramente determinati; ma la complessa regolamentazione dei Fondi, non sembra del tutto coerente con tali obiettivi: intanto perché l’incentivazione ex post degli investimenti in ricerca nei settori dove esistano importanti unmet needs, sembra essere una scelta economicamente poco efficiente; in secondo luogo perché i benefici dell’innovatività sono significativamente ridotti da una serie di rischi e incertezze derivanti dal modello adottato per il suo riconoscimento; infine perché la scelta di ripartire i Fondi in base alla spesa, malgrado i chiarimenti fornito dal citato Decreto Ministeriale, contiene elementi problematici rispetto alla gestione dell’appropriatezza dei consumi.
A fronte delle incertezze descritte, le Regioni hanno a loro volta legiferato, con obiettivi e scelte programmatorie affatto omogenee.
Tralasciando l’analisi delle singole normative regionali, sembrano emergere due principali preoccupazioni, peraltro convergenti in termini di programmazione.
Innanzitutto, sembra che le Regioni ritengano “doveroso” attenersi ad un atteggiamento finanziario prudenziale, come evidente nelle assegnazioni ridotte rispetto alle somme accertate.
Spesso l’assegnazione è fatta al lordo dei pay-back (che invece va nettato), con l’esito che non tutto l’ammontare disponibile verrà speso.
La seconda preoccupazione è che le Regioni sembrano paventare il rischio di un uso non appropriato dei farmaci, come si evince nella budgettizzazione a priori dei limiti di costo e, in alcuni casi, ad esempio in Veneto, anche dei pazienti presi in carico. Malgrado a livello nazionale la questione dell’uso appropriato dei farmaci innovativi sembri riassorbita dalla previsione dei registri di monitoraggio, a livello regionale la preoccupazione sembra invece restare viva.
Da questo punto di vista, particolarmente esplicita nelle sue finalità è l’indicazione della Regione Puglia di cui alla circolare del 19.9.2017, che recita «… considerato infine che la Puglia è una regione sottoposta a Piano Operativo oggetto di valutazione da parte delle Amministrazioni Centrali e che, laddove clinicamente possibile, a parità di indicazione, efficacia, sicurezza e tollerabilità, l'utilizzo delle terapie a minor costo consentirebbe, fermo restando il rispetto dei tetti di spesa farmaceutica e dei criteri di appropriatezza prescrittiva previsti dall'AlFA, di trattare un numero maggiore di pazienti con i fondi economici messi a disposizione dallo stato, è doveroso evidenziare che dovranno essere privilegiati gli schemi terapeutici a minor costo per il SSR»; al di là dei caveat nel testo, appare evidente la preoccupazione finanziaria, ovviamente legata all’esistenza di un monitoraggio centrale sul Piano Operativo; ma risulta difficile valutare il richiamo al fatto di privilegiare le prestazioni a minor costo, non essendo chiaro in che “relazione” sia da considerarsi il maggior costo con la maggiore efficacia/innovatività delle terapie.
In definitiva, a livello regionale, le preoccupazioni finanziarie sembrano prevalere su quelle dell’accesso all’innovazione. Atteggiamento spiegabile con il fatto che eventuali sforamenti entrerebbero a far parte delle somme calcolate ai fini del rispetto del tetto sulla spesa farmaceutica. Rischi di sforamento che le Regioni potenzialmente attribuiscono ad una eventuale insufficienza complessiva dei Fondi (in effetti, con il previsto ripiano della spesa “a piè di lista” non avrebbero controllo sui livelli di spesa delle altre Regioni), ovvero ad un uso non appropriato dei farmaci.
In termini operativi, l’applicazione dei criteri di riparto previsti evidenziano come, in termini pro-capite, le differenze (dipendenti dai pesi utilizzati per il riparto, a loro volta legati all’età) favoriscano le Regioni settentrionali, (mediamente più vecchie): si va da € 9,72 pro-capite della Liguria agli € 8,93 della Campania, con uno scarto di 0,79 punti percentuali.
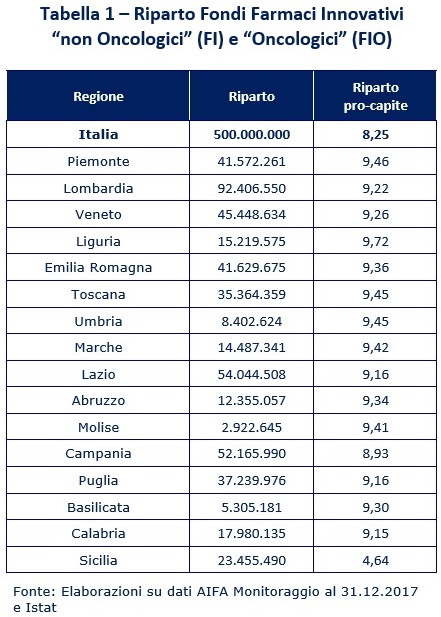
Per quanto concerne la spesa effettivamente sostenuta (al 2017), iniziamo con il sottolineare che i farmaci non oncologici innovativi rappresentano una quota pari al 18,3% della spesa di classe A, variando dal 26,4% della Lombardia al 10,9% della P.A. di Bolzano; della spesa di classe H, invece, rappresentano una percentuale minima (0,1%).
I farmaci innovativi oncologici rappresentano (sempre nel 2017), di contro, una quota significativa, il 6,7%, della spesa di classe H: variando dall‘8,0% della P.A. di Bolzano al 4,8% della Calabria.
Complessivamente gli innovativi incidono per l’11,9% (8,7%-15,4%) della spesa di classe A e H.
In termini netti, ovvero sottraendo i pay-back, l’incidenza è più che dimezzata (5,0% in media, con una variazione regionale nel range 3,3%-7,0%).
In assenza del dato di consumo, ciò che più interessa è la effettiva spesa regionale.
La Tabella 2 fornisce le risultanze in termini assoluti e pro-capite.
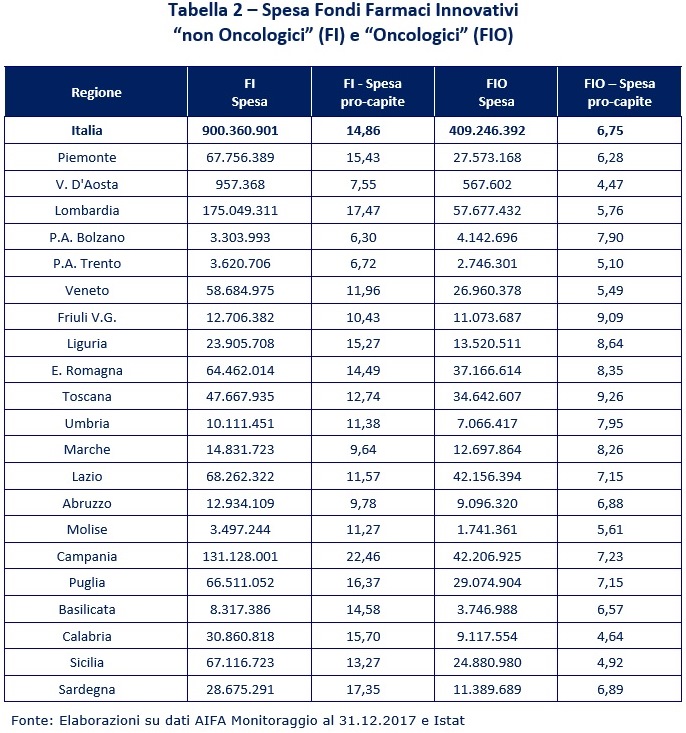
La prima osservazione riguarda la variabilità a livello regionale: con tutta evidenza è molto elevata e non giustificabile con le differenze di riparto sopra evidenziate.
Per gli innovativi (non oncologici) a fronte di una spesa media di € 14,9 pro-capite, si va dagli € 6,3 della P.A. di Bolzano ai 22,46 della Campania; per quelli oncologici la spesa media pro-capite è pari a € 6,8, variando da € 4,5 della Valle d’Aosta a € 9,3 della Toscana.
Differenze così marcate confermano la confusione (almeno iniziale) nella gestione della partita, già richiamata dalla breve analisi delle normative regionali reperite.
Nella misura in cui il vincolo di risorse aggiuntive doveva garantire un equo accesso ai farmaci innovativi, sembra che si possa dubitare che ciò sia avvenuto nel primo anno di applicazione, o almeno che lo sia nella misura desiderata.
Questa situazione, senza alcun dubbio, richiede, come sopra argomentato, di rivedere i criteri di riparto, introducendo, oltre al criterio della residenza (già previsto), anche quello del “consumo appropriato”, che può essere minore o maggiore di quello effettivamente erogato a livello regionale.
Da ultimo consideriamo, anche a conferma di quanto argomentato, che sebbene apparentemente il FI abbia “sforato” il tetto previsto, al netto dei pay-back (e delle altre forme di ritorno/sconto finanziario al SSN, quali MEA, tetti di prodotto, etc.) rimane, invece, abbondantemente al di sotto.
La tabella 3 riassume la spesa netta del SSN e le quote di utilizzazione dei Fondi.
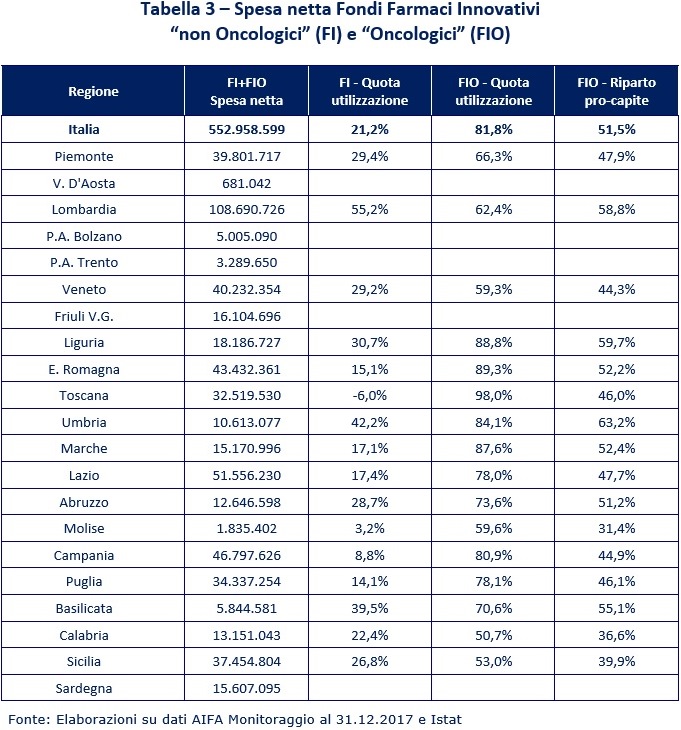
Appare immediatamente evidente che solo poco più della metà dei Fondi disponibili (senza considerare le Regioni a statuto speciale che, come sottolineato, provvedono con risorse proprie) è stata utilizzata: ovvero il 51,5% del Fondo totale; la quota sale al 81,8% considerando solo il FIO, mentre è solo del 21,2% per il FI.
Nessuna Regione arriva a utilizzare il riparto previsto: sebbene manchi il dato della mobilità che probabilmente ridurrebbe alcune apparenti anomalie; per il FI si va da un utilizzo del 3,2% del Molise al 53,6% della Sicilia; per il FIO si va, ancora, dal 31,4% del Molise al 79,8% della Sicilia.
Senza contare che alcuni pay-back di competenza dell’anno, saranno esigibili solo con il successivo.
Riflessioni finali
L’istituzione del Fondo farmaci Innovativi e poi di quello per gli innovativi oncologici ha il duplice, ed evidente, obiettivo di garantire l’accesso dei pazienti alle innovazioni e di incentivare le Aziende a investire in terapie ad alto valore terapeutico aggiunto.
Trattasi di obiettivi pienamente condivisibili, la normativa che ne è scaturita presenta, però, alcuni elementi critici.
Abbiamo argomentato come, tralasciando le note sul modello di valutazione dell’innovazione, gli incentivi messi in campo siano di dubbia efficienza rispetto al secondo degli obiettivi dichiarati; si paventa il rischio di una situazione distorsiva, vuoi in tema di riparto, vuoi in termini di incentivo per le Regioni, nel garantire un equo e appropriato accesso all’innovazione.
Sebbene il legislatore nazionale sembri confidente sui limitati rischi di inappropriatezza, a livello regionale appare esserci molta “circospezione” nell’affidare il controllo dell’appropriatezza ai soli registri di monitoraggio.
Su questo punto, i comportamenti delle Regioni, per quelle di cui si è trovato esplicito riscontro normativo, appaiono confermare i dubbi esposti: sembra, infatti, essere largamente prevalso un approccio ispirato alla prudenza contabile e al timore di sforamenti dei tetti di spesa previsti.
Il tutto trova conferma nei dati di spesa 2017: complessivamente viene utilizzata poco più della metà delle risorse disponibili e nessuna Regione si avvicina alle quote di riparto disponibili: a meno di clamorose sovrastime dei bisogni, l’obiettivo di incentivare l’accesso all’innovazione sembra non raggiunto.
Anche se, proiettando i dati disponibili fino ad Aprile 2018, sembra che i Fondi potrebbero diventare rapidamente incapienti, il rischio è che invece rimangano ancora avanzi, considerando tanto che il monitoraggio non sconta adeguatamente i ritorni dei pay-back, quanto che nel 2018 escono dai Fondi 8 molecole, e nel 2019 altre 6.
Ciò che lascia maggiormente perplessi, al netto di alcune carenze di informazione, è però la variabilità regionale dei consumi: infatti, essa è estremamente elevata, senza giustificazioni epidemiologiche sufficienti a spiegarla.
Questo implica che le Regioni debbano potenziare il processo programmatorio e di monitoraggio, in modo da contemperare da una parte il diritto all’accesso e dall’altro un uso appropriato che eviti sprechi, garantendo la sostenibilità.
Quindi, la programmazione dovrebbe considerare le somme disponibili e anche l’esistenza dei pay-back; inoltre dovrebbe basarsi su una stima dei pazienti da trattare (appropriatamente) con gli innovativi.
Appare allora evidente come, nello spirito dell’istituzione dei Fondi, debba essere risolto il problema del monitoraggio dell’equo accesso all’innovazione: la norma prevede che il Comitato paritetico permanente per la verifica dell’erogazione dei LEA, di cui all’Intesa del 23.5.2005, monitori gli effetti dei Fondi. Per quanto argomentato sarà essenziale che non si limiti ad un controllo ex post sugli esiti delle innovazioni, ma che lo faccia intanto precedere da una analisi ex ante dei livelli di accesso effettivamente garantiti.
In conclusione, la materia è complessa e forse la normativa è stata formulata senza che sia ancora seguita una compiuta analisi di tutti i suoi effetti diretti e indiretti: per completezza, anche visto l’utilizzo che ne è stato fatto, non sarebbe neppure da escludersi un ripensamento sulla necessità di avere dei Fondi aggiuntivi, che configurano dei “silos nel silos” della farmaceutica: un ripensamento del tetto della farmaceutica dovrebbe rimanere una opzione all’ordine del giorno; le risorse dei Fondi potrebbero diventare un significativo contributo ad un suo ampliamento utilizzando sempre adeguati incentivi a garantire un appropriato accesso all’innovazione.
D’altra parte, l’esperienza descritta, a fronte della variabilità della spesa Regionale, porta a concludere che non sia eludibile un monitoraggio sull’equità di accesso, sviluppando la quale si genererebbe anche un adeguato incentivo al consumo dei farmaci innovativi.
F. Spandonaro, D. d’Angela, B. Polistena
Università degli Studi di Roma “Tor Vergata” e C.R.E.A. Sanità