stampa | chiudi
Venerdì 12 GIUGNO 2020
Un modo più “semplice” per presentare le evidenze scientifiche di un nuovo farmaco
Gentile Direttore,
il ruolo delle evidenze è alla base dei processi decisionali che portano all’appropriatezza nella pratica clinica. Una decisione clinica è infatti il frutto di un complesso meccanismo di scelte in cui il professionista sanitario è chiamato a tener conto delle linee guida/evidenze. Recentemente, una delle principali sfide che il nostro servizio sanitario nazionale deve affrontare è il costante aumento delle novità in campo terapeutico.
Lo scenario sta diventando sempre più complesso perché la ricerca clinica avanza velocemente (es. in oncologia). In particolare, nelle valutazioni di innovatività c’è un chiaro cambio di paradigma che complica lo scenario dei farmaci.
Un tempo eravamo abituati a vedere un farmaco innovativo come rappresentante di una classe farmacologica nuova, e di solito “unico” rappresentante di tale classe (ad es., bevacizumab, trastuzumab, rituximab, etc). Oggigiorno, invece, non abbiamo il tempo di imparare il nome di un nuovo farmaco che subito ne escono altri due o tre della stessa famiglia.
Ad es., nivolumab, pembrolizumab, atezolizumab; oppure olaparib, niraparib, rucaparib. Se si pensa a quanto lavoro è richiesto per stimare il valore terapeutico di un’unica molecola, immaginiamo il tutto riferito ad una classe, la cui valutazione, oltre che verso la vecchia terapia, deve avvenire anche tra “congeneri”.
Lo standard attuale nel campo delle evidenze rimane lo studio randomizzato controllato (RCT), che esamina il confronto “diretto” tra terapia nuova e vecchia terapia. Quando le novità appartenenti alla medesima classe sono 2 oppure 3 oppure 4 (i “congeneri” innovativi: ad es. I1, I2, I3, I4, affiancati ad S, il vecchio standard), il quadro dei confronti si complica. Gli RCT disponibili saranno solamente I1 vs S, I2 vs S, I3 vs S, I4 vs S (confronti diretti), ma mancheranno gli RCT riguardo ai confronti tra congeneri innovativi (cioè: I1 vs I2, I1 vs I3, I2 vs I3, I2 vs I4, I3 vs I4,), detti “indiretti” proprio per la mancanza di RCT.
La metanalisi a “rete” (network meta-analysis, NetMa) è il principale strumento che esegue confronti indiretti. Da un punto di vista metodologico la NetMa rappresenta una scelta scientificamente corretta, ma è ormai evidente che, per la sua complessità statistica, la NetMa è inadatta a supportare le scelte di governo. Basti dire che AIFA, chiamata a più riprese a valutare l’equivalenza dei congeneri innovativi, mai si è avvalsa di una NetMa a scopo decisionale.
Anche la più grande e autorevole organizzazione internazionale dedita alle revisioni sistematiche (Cochrane Collaboration) produce documenti metodologicamente ineccepibili e orientati a eseguire tutti i possibili confronti diretti e/o indiretti. Però si tratta di mega-documenti articolati su centinaia di pagine, che poi non vengono scelti come riferimento principale da parte delle istituzioni di governo clinico.
Dopo l’era della complessità statistica, sta profilandosi il ritorno, per cause di forza maggiore, alle vecchie e “amatissime” revisioni narrative. Cominciano infatti a circolarne esempi via via più numerosi. Poiché siamo nel 2020, oltre alla pura narrazione, qualcosa di statistico ovviamente serve. In questo quadro non solo stanno riproponendosi le revisioni narrative ma, dopo anni di scarso utilizzo, sta “rinascendo a nuova vita” uno strumento di analisi ricco di pregi e scevro di difetti: il restricted mean survival time (RMST).
L’RMST, per farla breve, rappresenta il tempo medio di sopravvivenza libera da progressione (o da “decesso”). E’ ritenuto un analogo della mediana, ma - a differenza della mediana - ha vantaggi importanti:
1) è sempre calcolabile anche quando gli eventi sono pochi;
2) è capace di cogliere la cosiddetta “coda di destra” dei lungo sopravviventi (un elemento importantissimo per l’oncologia innovativa). L’RMST consente inoltre di stilare una sorta di classifica di merito in base all’efficacia (“ranking”) andando a identificare chi è risultato il “migliore” o il “peggiore”, ma valutando pure la rilevanza o irrilevanza delle differenze riscontrate.
Figura. (A) Rappresentazione del restricted mean survival time; (B) Valori di RMST per 17 trattamenti di prima linea nella leucemia linfatica cronica
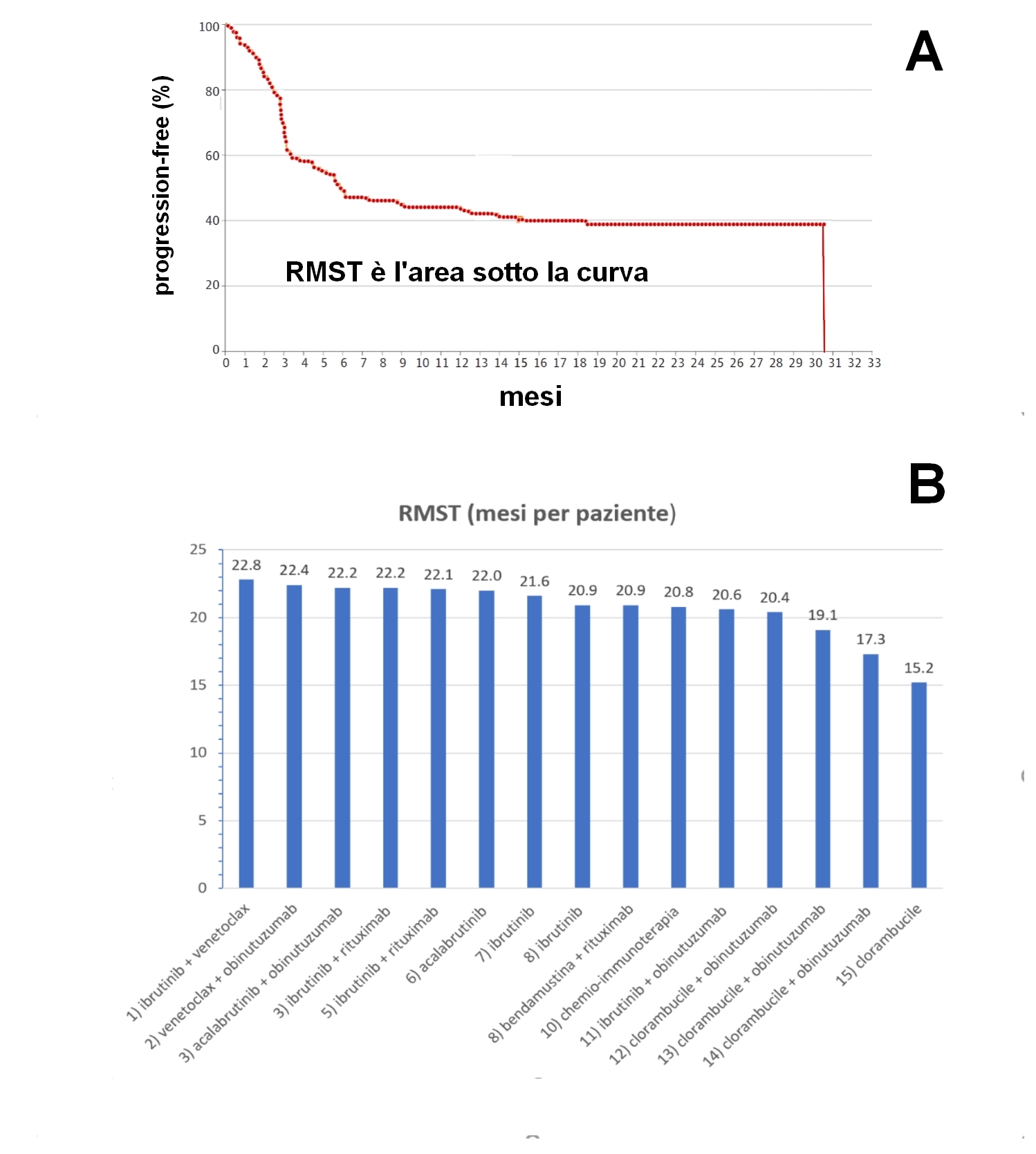
Chi è chiamato a prendere decisioni ha bisogno di una chiave di lettura semplice e concisa allo scopo di facilitare il trasferimento dalla scienza alle decisioni (principio cardine dell’HTA). L’RMST sembra essere molto efficiente in questo ruolo.
In conclusione, possiamo dire che il palesarsi di un nuovo scenario terapeutico, costellato non più da una singola “novità” ma da un insieme di novità contemporanee e molto simili tra loro, ha creato la necessità di presentare le evidenze come un dato intenzionalmente semplice di facile trasferibilità nella pratica, così da poter essere rapidamente adottato dal decisore.
Elisa Ferracane, Sabrina Trippoli, Andrea Messori
UOS Supporto Politiche Regionali sul Farmaco, ESTAR Toscana
Nota: Le posizioni espresse nell’articolo non necessariamente coincidono con quella dell’Ente in cui gli autori operano.