di informazione sanitaria
Lunedì 29 APRILE 2024
Anemia con Sindromi Mielodisplastiche a basso rischio. Da Bristol Myers Squibb i primi risultati di luspatercept
I risultati dello studio di Fase 3 Commands mostrano che quasi il doppio dei pazienti trattati con luspatercept ha ottenuto una indipendenza dalle trasfusioni con conseguente aumento dell’emoglobina rispetto ad epoetina alfa, compresi i sottogruppi di pazienti clinicamente rilevanti. Luspatercept ha dimostrato una risposta duratura con un’indipendenza mediana da trasfusioni di circa 2,5 anni, 1 anno in più rispetto a epoetina alfa.
31 MAG -Bristol Myers Squibb annuncia i primi risultati dello studio di Fase 3 COMMANDS, randomizzato, in aperto, per la valutazione di luspatercept rispetto ad epoetina alfa, un agente stimolante dell’eritropoiesi (ESA), per il trattamento dell’anemia nei pazienti adulti con sindromi mielodisplastiche (MDS) a rischio molto basso, basso o intermedio, che richiedono trasfusioni di globuli rossi (RBC) e sono ESA-naïve.
I risultati dello studio saranno presentati al Congresso della Società Americana di Oncologia Clinica (American Society of Clinical Oncology, ASCO) il 2 giugno e in una presentazione orale degli abstract selezionati durante la sessione plenaria del Congresso dell’Associazione Europea di Ematologia (European Hematology Association, EHA) il 10 giugno.
“Anemia cronica, bassi livelli di emoglobina e dipendenza dalle trasfusioni rappresentano le principali sfide cliniche per i pazienti con sindromi mielodisplastiche a basso rischio e aumentano il rischio di morte di oltre la metà dei pazienti rispetto a coloro che non necessitano di trasfusioni”, afferma Guillermo Garcia-Manero, M.D., sperimentatore principale e Direttore della Section of Myelodysplastic Syndromes alla University of Texas MD Anderson Cancer Center. “I risultati dello studio COMMANDS hanno mostrato che il trattamento con luspatercept, rispetto ad epoetina alfa, ha prodotto tassi superiori e statisticamente significativi di indipendenza da trasfusioni di globuli rossi e di aumento di emoglobina, miglioramento della durata della risposta, con risultati pari o superiori in tutti i sottogruppi, e con sicurezza e tollerabilità accettabili per i pazienti con sindromi mielodisplastiche a basso rischio ESA-naïve”.
L’endpoint primario analizzato nello studio COMMANDS è l’indipendenza dalle trasfusioni di globuli rossi (RBC-TI) per 12 settimane con un aumento medio dell’emoglobina pari o superiore a 1,5 g/dL. Gli endpoint secondari comprendono la risposta eritroide (HI-E) per almeno 8 settimane durante le settimane dalla 1 alla 24 dello studio, RBC-TI ≥12 settimane e RBC-TI per 24 settimane. I pazienti eleggibili sono di età ≥18 anni con MDS a basso rischio e con necessità di trasfusioni. I pazienti sono randomizzati 1:1 a ricevere luspatercept sottocute (dose iniziale 1,0 mg/kg, titolazione fino a 1,75 mg/kg) una volta ogni tre settimane oppure epoetina alfa (dose iniziale 450 IU/kg, titolazione fino a 1050 IU/kg) settimanalmente per ≥24 settimane.
Risultati dello studio COMMANDS per ASCO
Al momento dell’analisi ad interim, 147 pazienti valutabili ricevevano luspatercept e 154 ricevevano epoetina alfa, con la durata media del trattamento di 41,6 e 27 settimane, rispettivamente. I risultati hanno mostrato che il 58,5% (n=86) dei pazienti trattati con luspatercept rispetto al 31,2% (n=48) di quelli trattati con epoetina alfa ha raggiunto l’endpoint primario di RBC-TI per almeno 12 settimane con conseguente aumento medio di emoglobina di almeno 1,5 g/dL entro le prime 24 settimane (p<0,0001). L’aumento del tasso di HI-E per almeno 8 settimane è stato raggiunto dal 74,1% (n=109) dei pazienti con luspatercept rispetto al 51,3% (n=79) di quelli con epoetina alfa (p<0,0001). I pazienti trattati con luspatercept hanno ottenuto risposte più durature rispetto ad epoetina alfa, con una durata mediana della risposta di RBC-TI >12 settimane (dalla settimana 1 al termine del trattamento) di 126,6 rispetto a 77 settimane. Nelle prime 24 settimane di trattamento, RBC-TI di almeno 24 settimane era stata raggiunta dal 47,6% (n=70) dei pazienti con luspatercept rispetto al 29,2% (n= 45) di quelli con epoetina alfa (P= 0,0006). I benefici del trattamento con luspatercept sono stati osservati anche nei sottogruppi clinicamente rilevanti e i risultati hanno mostrato un profilo di sicurezza costante senza nuove segnalazioni.

Risultati dello studio COMMANDS per EHA
I dati che saranno presentati all’EHA comprendono efficacia e sicurezza coerenti con i risultati presentati all’ASCO e dimostrano esiti favorevoli con luspatercept rispetto ad epoetina alfa nelle MDS con mutazioni comuni (SF3B1, SF3B1a, ASXL1, TET2, DNMT3A, EZH2, IDH2, U2AF1) in termini di una maggiore probabilità di ottenere benefici clinici, indipendentemente dal profilo mutazionale complessivo.
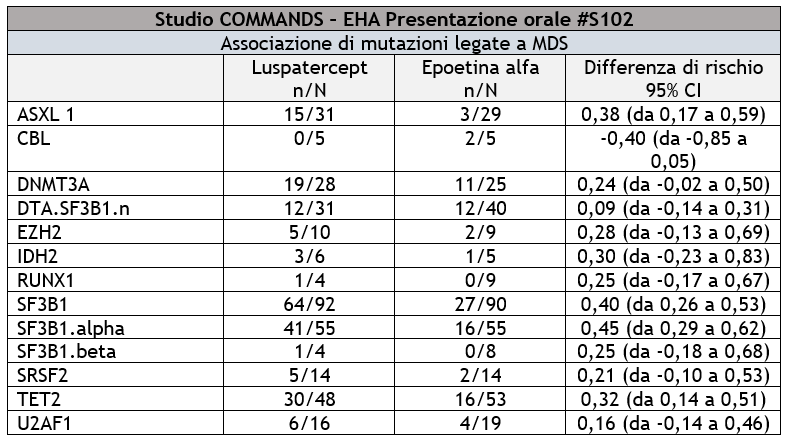
Una richiesta di Biologics License supplementare per luspatercept nel trattamento dell’anemia nei pazienti adulti con MDS a rischio da molto basso a intermedio ESA-naïve che possono necessitare di trasfusioni di globuli rossi è attualmente in fase di revisione con procedura prioritaria da parte della U.S. Food and Drug Administration (FDA), con una data di scadenza del Prescription Drug User Fee Act (PDUFA) assegnata al 28 agosto 2023. Anche l’Agenzia europea per i medicinali ha validato la richiesta della variazione di Tipo II per autorizzare luspatercept in questa popolazione di pazienti. Luspatercept è sviluppato e commercializzato attraverso una collaborazione globale con Merck a seguito dell’acquisizione di Acceleron Pharma, Inc. da parte di Merck nel novembre 2021.
“L’esperienza clinica ha dimostrato che solo un paziente su tre con sindrome mielodisplastica a basso rischio mostra risposte agli agenti stimolanti eritroidi nell'arco di 6-18 mesi, confermando una significativa necessità di opzioni più efficaci per affrontare l'anemia cronica”, afferma Matteo Giovanni Della Porta, sperimentatore dello studio e Direttore della Leukemia Unit all’Humanitas Cancer Center di Milano, Italia. “Nello studio COMMANDS, la durata mediana dell’indipendenza da trasfusioni di globuli rossi era circa un anno superiore con luspatercept rispetto ad epoetina alfa e luspatercept ha mostrato un profilo di sicurezza coerente con quello già noto, dimostrando il suo potenziale come trattamento di prima linea nei pazienti con MDS a rischio da molto basso a intermedio, dipendenti da trasfusione”.
“I risultati che saranno presentati all’ASCO ed EHA rafforzano il concetto che luspatercept potrebbe essere usato come trattamento iniziale dell’anemia nei pazienti con sindromi mielodisplastiche a rischio da molto basso a intermedio”, sostiene Noah Berkowitz, M.D., Ph.D., Vicepresidente senior, Hematology Development, Bristol Myers Squibb. “Come opzione di trattamento di prima linea potenzialmente più efficace e duratura, luspatercept potrebbe cambiare il paradigma dello standard di cura per questi pazienti”.
31 maggio 2023
© Riproduzione riservata
Altri articoli in Scienza e Farmaci
Quotidiano online
d'informazione sanitaria.
QS Edizioni srl
P.I. 12298601001
Sede legale:
Via Giacomo Peroni, 400
00131 - Roma
Sede operativa:
Via della Stelletta, 23
00186 - Roma
Luciano Fassari
Direttore editoriale
Francesco Maria Avitto
info@qsedizioni.it
redazione@qsedizioni.it
Coordinamento Pubblicità
commerciale@qsedizioni.it
- Joint Venture
- SICS srl
- Edizioni
Health Communication srl
- P.I. 12298601001
- iscrizione al ROC n. 23387
- iscrizione Tribunale di Roma n. 115/3013 del 22/05/2013
Riproduzione riservata.
Policy privacy






