L'Aifa ha pubblicato questa mattina i risultati del Rapporto annuale sulla sicurezza dei vaccini anti Covid che raccoglie i dati dell'attività di farmacovigilanza, sia passiva che attiva, dal 27 dicembre 2020 al 26 dicembre 2021.
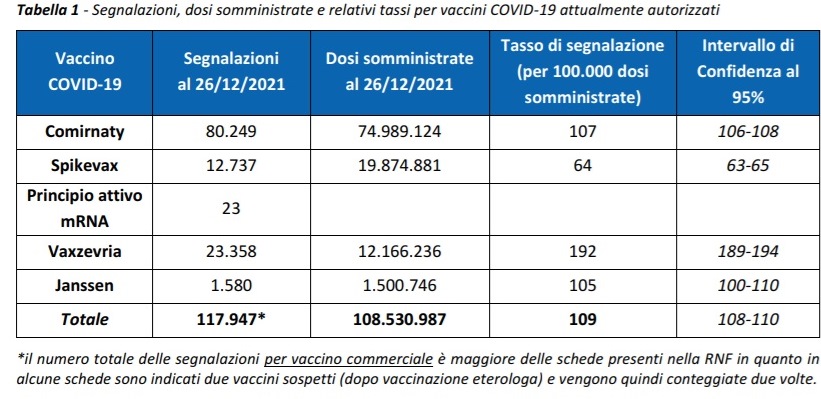
In questo arco di tempo sono state inserite complessivamente nella Rete Nazionale di Farmacovigilanza 117.920 segnalazioni di sospetto evento avverso successivo alla vaccinazione su un totale di 108.530.987 dosi di vaccino, con un tasso di segnalazione di 109 segnalazioni ogni 100.000 dosi somministrate, indipendentemente dal vaccino e dalla dose.
L'Aifa ricorda che una segnalazione non implica necessariamente, né stabilisce in sé, una causalità tra vaccino ed evento, ma rappresenta un sospetto che richiede ulteriori approfondimenti, attraverso un processo definito “analisi del segnale”.
Le segnalazioni riguardano soprattutto Comirnaty (68%), che è stato il vaccino più utilizzato e solo in minor misura Vaxzevria (19,8%), Spikevax (10,8%) e vaccino COVID‐19 Janssen (1,4%).
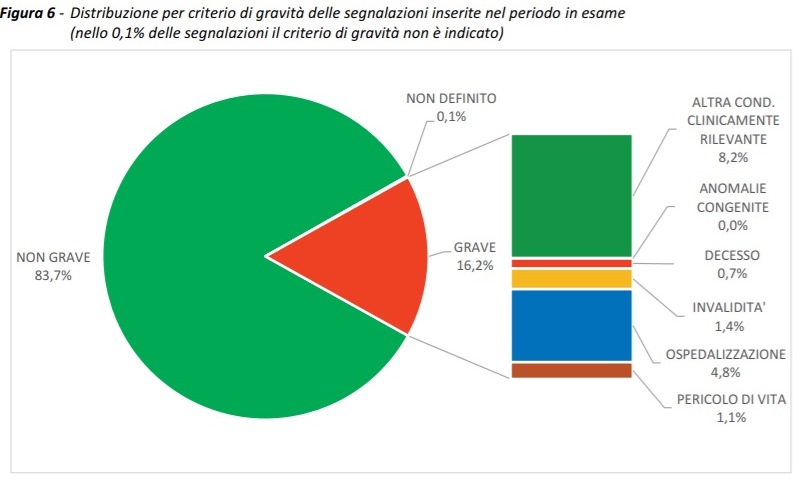
Tipologia eventi avversi. L’83,7% (n. 98.717) delle segnalazioni inserite è riferita a eventi non gravi, con un tasso di segnalazione pari a 91/100.000 dosi somministrate, e il 16,2% (n. 19.055) a eventi avversi gravi, con un tasso di 17,6 eventi gravi ogni 100.000 dosi somministrate, indipendentemente dal tipo di vaccino, dalla dose somministrata e dal possibile ruolo causale della vaccinazione.
Complessivamente quindi i sospetti eventi avversi gravi segnalati sono riferibili solo allo 0,002% delle somministrazioni effettuate.
Eventi avversi più comuni. Per tutti i vaccini gli eventi avversi più segnalati sono stati febbre, stanchezza, cefalea, dolori muscolari/articolari, dolore in sede di iniezione, brividi e nausea. Gli eventi riportati sono perlopiù non gravi e già risolti al momento della segnalazione.
Per quanto riguarda la somministrazione della terza dose, iniziata nel mese di settembre, al 26 dicembre 2021 sono state inserite 3.510 segnalazioni, a fronte di 16.198.231 di terze dosi somministrate, con un tasso di segnalazione di 21,7 segnalazioni ogni 100.000 terze dosi, inferiore a quanto osservato per le dosi del ciclo primario. L’84,1% (n. 2.951) delle segnalazioni è riferita a eventi non gravi, con un tasso di segnalazione pari a 18,2 ogni 100.000 dosi somministrate, e il 15,9% (558) a eventi avversi gravi, con un tasso di 3,4 segnalazioni di eventi gravi ogni 100.000 dosi somministrate.
Sono pervenute 730 segnalazioni dopo vaccinazioni eterologhe, che prevedono l’utilizzo di 2 diversi vaccini COVID-19 per i cicli di vaccinazione primaria (vaccinazione primaria eterologa) o per le dosi di richiamo 3-6 mesi dopo il ciclo di vaccinazione primaria (richiamo eterologo). La maggior parte delle segnalazioni dopo vaccinazione eterologa sono relative alla somministrazione di un vaccino a mRNA dopo prima somministrazione di un vaccino a vettore adenovirale, sono per la maggior parte non gravi e presentano le stesse caratteristiche del resto delle segnalazioni.
In merito alle vaccinazioni in età pediatrica (5-16 anni), al 26/12/2021 risultano somministrate 4.178.361 di dosi di vaccino, il 96% delle quali nella fascia di età 12-16 anni (4.005.471 dosi) e il 4% nella fascia 5-11 anni (172.890 dosi).
Tra i due vaccini autorizzati per questa popolazione, Comirnaty è stato il più utilizzato (87,5%), (Spikevax 12,5%). Al 26 dicembre 2021 sono state registrate complessivamente 1.170 segnalazioni di sospette reazioni avverse manifestatesi nella popolazione pediatrica, che rappresentano l’1% di tutte le segnalazioni, con un tasso di segnalazione pari a 28 eventi ogni 100.000 dosi somministrate nella fascia pediatrica, indipendentemente dalla tipologia di vaccino e dalla valutazione del nesso di causalità, inferiore dunque rispetto a quello riscontrato nella popolazione generale (109 eventi ogni 100.000 dosi somministrate).
Nella popolazione pediatrica gli eventi avversi più frequentemente segnalati sono febbre, cefalea, stanchezza e vomito. Il 69% delle reazioni si sono risolte completamente o erano in miglioramento al momento della segnalazione.
I tassi di segnalazione nella fascia d’età 5-11 sono preliminari e al momento non emergono particolari problemi di sicurezza.
Vaccinazione anti-COVID-19 in gravidanza
Nonostante le preoccupazioni iniziali dovute principalmente alla mancanza di disponibilità di dati di immunogenicità, efficacia e sicurezza dei vaccini nelle donne in gravidanza, è apparsa evidente la necessità di vaccinare tale popolazione alla luce anche dei rischi legati all’insorgenza di malattia COVID-19 per la madre o il feto. Infatti, le pazienti in gravidanza affette da COVID-19 sintomatico sembrano essere a maggior rischio di malattia grave rispetto alle pazienti non in stato di gravidanza, soprattutto in presenza di comorbilità.
L’Aifa sottolinea che le evidenze scientifiche ad oggi disponibili mostrano un buon profilo di sicurezza dei vaccini a mRNA per il trattamento del COVID-19 nelle donne in gravidanza, supportando e incentivando la vaccinazione in tale categoria di popolazione e che attualmente la vaccinazione anti-COVID-19 è indicata sia in gravidanza che in allattamento, in accordo alle posizioni in merito delle Società Scientifiche e alle Autorità Regolatorie sia nazionali e internazionali.
L'Aifa sottoliena poi che non vi sono evidenze che suggeriscano che i vaccini anti‐COVID‐19 possano influenzare negativamente la fertilità in entrambi i sessi.
L’effetto “nocebo”
L'Aifa ha riportato anche i dati sulle reazioni ansiose alla vaccinazione e gli eventi correlati allo stress da vaccinazione, ovvero quegli eventi determinati dalla risposta emotiva alla vaccinazione, il cosidetto effetto “nocebo”. Si tratta dei dati relativi a 12 studi internazionali, che hanno coinvolto un totale di
45.380 pazienti (22.802 che hanno ricevuto un vaccino e 22.578 un placebo), l’effetto nocebo ha rappresentato fino al 64% di tutte le reazioni avverse, con una frequenza di eventi avversi di tipo sistemico del 35,2% e di tipo locale del 16,2% nei pazienti trattati con placebo.
I decessi correlabili
Complessivamente sono stati segnalati 758 decessi di questi 580 sono stati ritenuti idonei alla valutazione del nesso di causalità secondo gli standard dell’Oms ma quelli risultati poi effettivamente correlabili alla vaccinazione sono solo 22 (il 3,8%, circa 0,2 casi ogni milione di dosi somministrate), sette in più rispetto ai 16 registrati nei precedenti nove rapporti mensili che hanno coperto il periodo 27 gennaio 2020/27 settembre 2021.
In base ai dati disponibili, osserva Aifa, è possibile che alcuni eventi attesi per i vaccini possano avere conseguenze clinicamente rilevanti in alcuni soggetti anziani fragili, specialmente se si presentano con particolare intensità (come l’iperpiressia), a fronte di un beneficio indubbio della vaccinazione in quella fascia della popolazione.
Queste le caratteristiche dei 22 decessi correlabili:
– 2 eventi sistemici che hanno scompensato pazienti fragili. Si tratta un uomo di 79 anni, con storia clinica di patologie cardiovascolari e di una paziente fragile di 92 anni, con storia clinica di demenza e diabete mellito. I due eventi avversi sistemici correlabile alal vaccinazione (ierpiressia, vomito) si sono hanno innescato uno scompenso delle condizioni cliniche fino al decesso;
– 10 trombosi con trombocitopenia dopo vaccini a vettore virale, per alcuni dei quali si sono recentemente resi disponibili i documenti clinici per la valutazione;
– 10 fallimenti vaccinali con malattia da SarS-CoV-2 comparsa tra 3 settimane e 7 mesi dal completamento del ciclo vaccinale. In due casi le pazienti presentavano condizioni cliniche e terapie compatibili con uno stato di immunosoppressione. In altri 8 casi, i pazienti avevano un’età compresa tra i 76 e i 92 anni, con una condizione di fragilità per pluripatologie.
L'Aifa precisa che, a fronte di nuove informazioni disponibili, il nesso di causalità di un caso con esito fatale a seguito di complicanze da porpora trombotica trombocitopenica, precedentemente ritenuto come correlato alla vaccinazione, è stato rivalutato e sulla base delle attuali conoscenze definito come indeterminato.
L’Aifa ha anche confrontato i decessi attesi con quelli osservati entro i 14 giorni dalla vaccinazione: per qualunque dose, i decessi osservati sono sempre nettamente inferiori ai decessi attesi. Non c’è quindi, nella popolazione di soggetti vaccinati, alcun aumento del numero di eventi rispetto a quello che ci si sarebbe aspettato in una popolazione simile ma non vaccinata.
Non sono vaccini sperimentali
L'Aifa interviene anche sul fatto, spesso richiamato da molti oppositori alla vaccinazione anti Covid, che questi vaccini siano sperimentali. “Va infatti sottolineato con estrema chiarezza – si legge nel rapporto Aifa – che nessuna delle fasi dello sviluppo pre-clinico e clinico (test di qualità, valutazione dell’efficacia e del profilo di sicurezza) dei vaccini è stata omessa e il numero dei pazienti coinvolti negli studi clinici è lo stesso di vaccini sviluppati con tempistiche standard”.
“Lo sviluppo clinico in tempi molto rapidi – sottolinea ancora l'Aifa – è stato possibile grazie a grandi investimenti economici e di know-how, che hanno permesso alle aziende farmaceutiche e alle istituzioni accademiche e di ricerca pubblica di affiancare temporalmente le diverse fasi di sviluppo clinico e di arruolare negli studi di fase 3 un numero molto elevato (decine di migliaia) di partecipanti.




















